Save the date: EMA organizuje Information Day for CTIS 17. října 2024
CTIS byl zřízen farmaceutickým zákonem v rámci Nařízení o klinických studiích (Nařízení (EU) č. 536/2014) a po 30. lednu 2025 kompletně nahradí původní systém pro klinické studie EudraCT (Databáze klinických studií orgánů pro regulaci léčiv Evropské unie).
Evropská léková agentura (EMA) průběžně publikuje zprávy, jak proces přechodu na nový systém pokračuje.
V předchozím článku jsme ukazovali, jaká byla situace v únoru 2024, v tomto článku jsme informace o počtu podání a rozhodnutí o přechodu aktualizovali ke konci srpna 2024.
Obr. č. 1 – Změny v počtu podaných žádostí, resp. v počtu podání, kde již bylo rozhodnuto, v porovnání s předchozím měsícem
Zdroj obrázku: EMA, CTIS newsflash – 10 September 2024
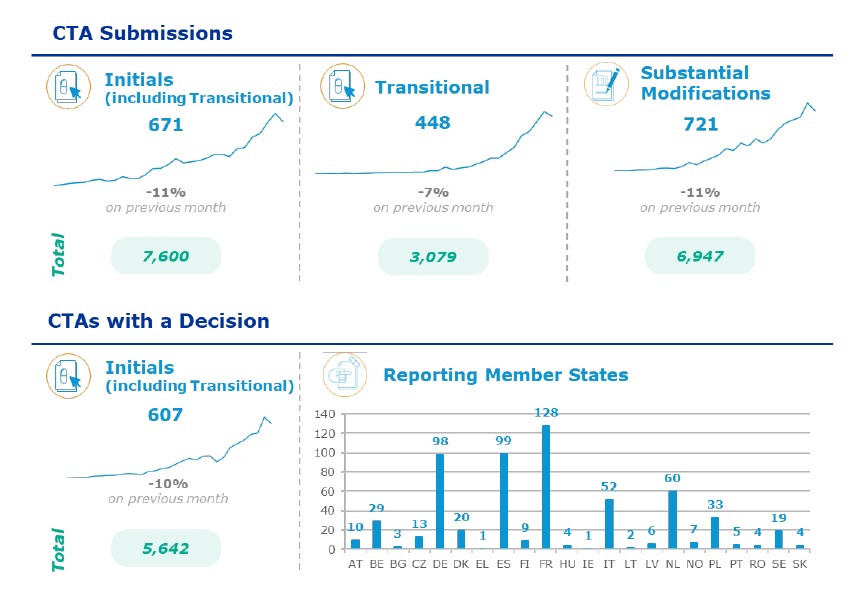
V průběhu léta aktivita podávání žádostí poklesla, ale ve srovnání se stavem v únoru je celkový počet podaných žádostí vice než dvojnásobný a počet studií s rozhodnutím je také skoro dvojnásobný.
Nicméně stále jsou klinické studie, pro které je třeba podat žádost.
EMA publikuje novinky v této oblasti každé dva týdny, kde mj. uvádí, jaké změny v systému CTIS provedla.
Také připravila Information Day for CTIS 17. října 2024 pro všechny zainteresované subjekty.
Uložte si datum do kalendáře a nepolevujte v přechodu vašich studií na nový systém.
---------------------------------------------------------------------------------------------------------------------------------
Důležité milníky pro klinické studie:
- Klinické studie zahájené po 30. lednu 2023 – všechny žádosti o počáteční klinické studie v Evropské unii (EU)/Evropském hospodářském prostoru (EHP) musí být podány prostřednictvím CTIS
- Klinické studie ukončené před 30. lednem 2025 – Klinická studie je spravována v systému EudraCT nebo národních systémech
- Klinické studie, u kterých se očekává, že budou pokračovat po 30. lednu 2025 – je nutný přechod z EudraCT nebo národních systémů na CTIS.
Obr. č. 2 – schéma přechodu na nový informační systém pro klinická hodnocení