Informační systém klinických studií (CTIS) - současnost a budoucnost
CTIS byl zřízen farmaceutickým zákonem v rámci Nařízení o klinických studiích (Nařízení (EU) č. 536/2014) a po 30. lednu 2025 kompletně nahradí původní systém pro klinické studie EudraCT (Databáze klinických studií orgánů pro regulaci léčiv Evropské unie). CTIS podporuje interakce mezi sponzory klinických studií (výzkumníky nebo společnostmi, které provádějí klinickou studii a shromažďují a analyzují data) a regulačními orgány v členských státech EU a zemích EHP po celou dobu životního cyklu klinické studie.
Systém CTIS je zajišťován Evropskou lékovou agenturou (EMA) a pracuje v zabezpečeném prostředí.
Důležité milníky pro klinické studie:
- Klinické studie zahájené po 30. lednu 2023 – všechny žádosti o počáteční klinické studie v Evropské unii (EU)/Evropském hospodářském prostoru (EHP) musí být podány prostřednictvím CTIS
- Klinické studie ukončené před 30. lednem 2025 – Klinická studie je spravována v systému EudraCT nebo národních systémech
- Klinické studie, u kterých se očekává, že budou pokračovat po 30. lednu 2025 – je nutný přechod z EudraCT nebo národních systémů na CTIS.
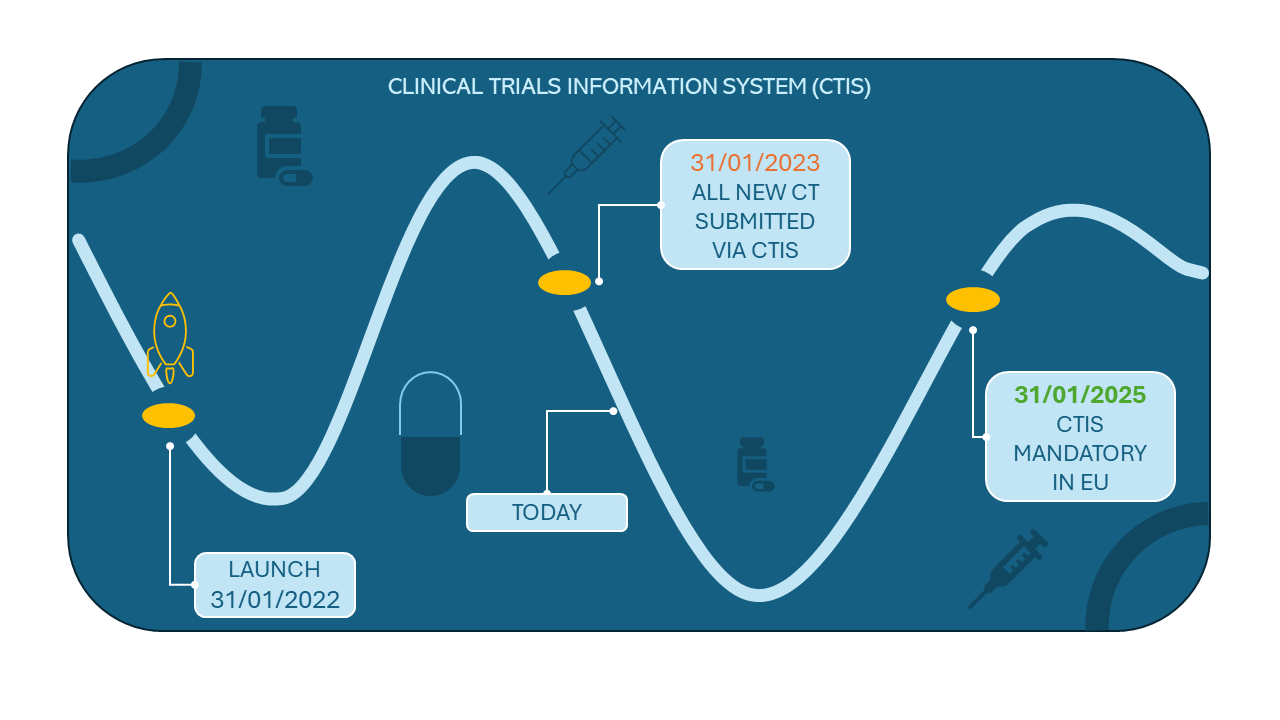
Ačkoliv lhůta na přechod z EudraCT do systému CTIS končí až za 11 měsíců, dle doporučení EMA by měl být přechod z EudraCT do CTIS zahájen bez prodlení.
V rámci procesu přenosu mezi systémy se může vyskytnout několik složitých bodů, na které stojí za to si dát pozor:
- Přechod by měl trvat 2 měsíce (dle metodiky EMA), ale je dobré připravit se na delší období. Jakmile je proces dokončen, veškeré informace a data jsou zpracovány prostřednictvím CTIS.
- Než se začne nová země účastnit klinické studie, musí být postupně dokončen přechod na CTIS ve všech zemích, které již KS provádějí.
- Národní jazyk, zejména ty se speciálními znaky, mohou být problémem. Je nutné poskytnout znaky používané v národním jazyce.
- Relace v pracovním prostředí CTIS může být nestabilní, v takovém případě nemusí být převod mezi systémy úspěšně dokončen a může být vyžadována opakování.
Protože systém není intuitivní a není snadno použitelný (zkušenosti), existují pokyny a otázky a odpovědi od EMA (odkaz) a také webináře (odkaz) pro uživatele a sponzory.
EMA také zveřejnila zajímavé video na zlepšení povědomí o regulaci systému klinických studií: https://youtu.be/0nQ2ABHa9L0?feature=shared.
V dalším videu EMA představuje pracovní prostředí CTIS a běžné funkce systému pro uživatele: https://youtu.be/NSQmVtqhmWo?feature=shared.
EMA pravidelně publikuje statistiky CTIS týdně (odkaz). Poslední zveřejněná data jsou k dispozici od 6. do 12. února
2024.
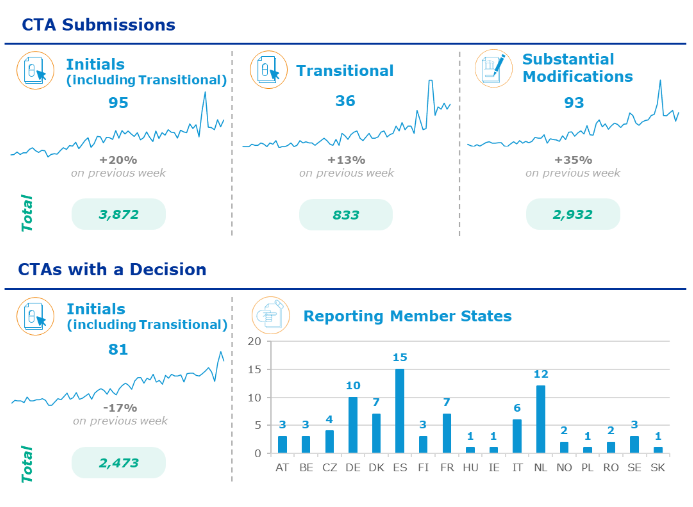
Navzdory obtížím bylo dosud provedeno 2473 úspěšných žádostí. Nicméně existuje také mnoho klinických studií, které ještě musí přechodem projít.
Pokud je to i případ vaší klinické studie, doporučujeme přenos do systému CTIS neodkládat.

