Sekce:
Vizualizace dat
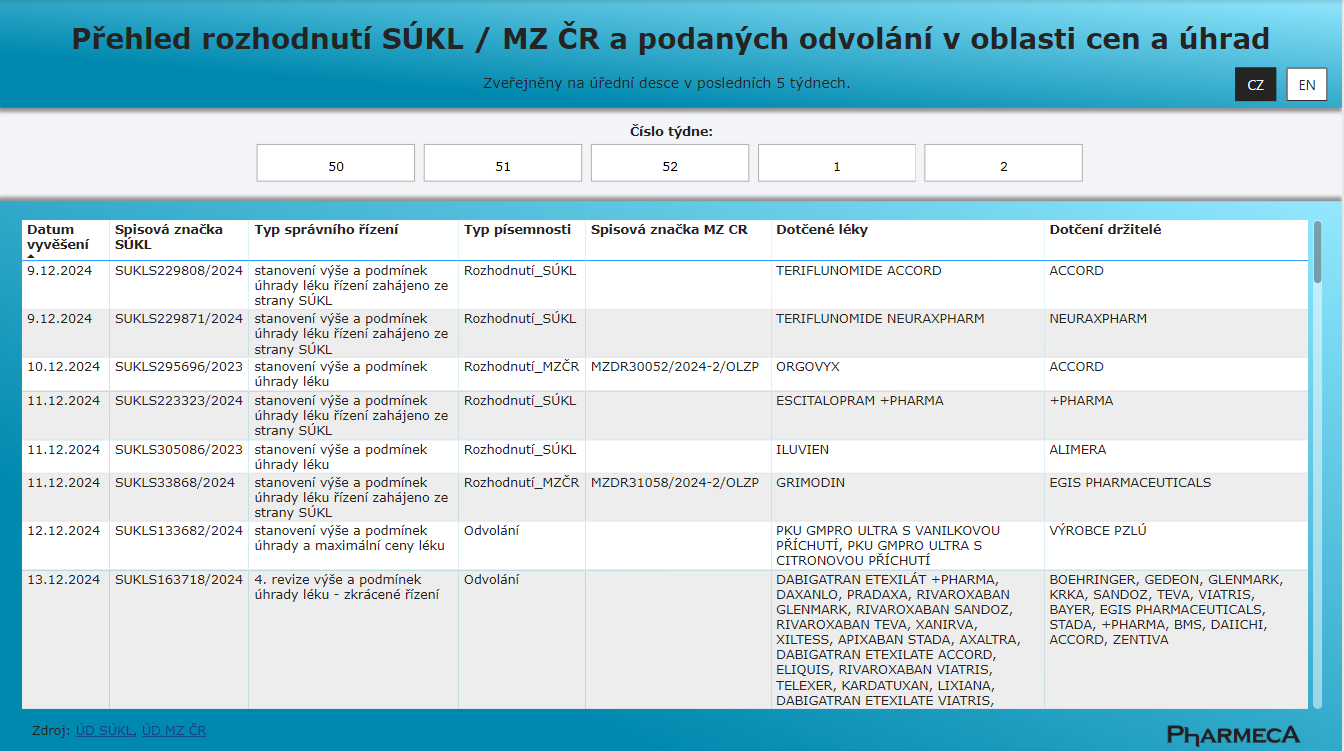
Rozhodnutí SÚKL a MZ ČR v oblasti cen a úhrad
Od 1. 1. 2025 nabízí společnost Pharmeca a.s. na svých stránkách přehled vydaných rozhodnutí SÚKL a MZ ČR v oblasti cen a úhrad.

Pharmeca a.s.
08. 01. 2025
Sekce:
Denní přehled
Vyjádření MZ ČR k otázce distribuce do zahraničí
Pharmeca a. s. upozorňuje výrobce, držitele rozhodnutí o registraci a distributory na vyjádření Ministerstva zdravotnictví ČR k otázce zákazu distribuce do zahraničí.
MZ ČR
06. 01. 2025
Sekce:
Denní přehled
Aktualizace seznamu referenčních zdrojů SÚKL
SÚKL aktualizoval seznam veřejně dostupných referenčních zdrojů cen léčiv a potravin pro zvláštní lékařské účely používaných pro účely cenové a úhradové regulace.
SÚKL
02. 01. 2025
Sekce:
Denní přehled
Aktualizace pokynu SÚKL
SÚKL aktualizoval pokyn týkající se regulace reklamy na humánní léčivé přípravky a lidské tkáně a buňky
SÚKL
31. 12. 2024
Sekce:
Denní přehled
Nové rozdělení léčivých látek do ATC skupin
SÚKL informuje o novém rozdělení léčivých látek do ATC skupin souvisejícím s vydáním aktualizované verze ATC/DDD Indexu platné od 1. 1. 2025.
SÚKL
21. 12. 2024
Sekce:
Denní přehled
Aktualizace pokynu SÚKL
SÚKL aktualizoval pokyn týkající se vydání stanoviska k návrhu specifického léčebného programu.
SÚKL
19. 12. 2024
Sekce:
Denní přehled
Nové datové rozhraní seznamu SCAU
SÚKL zveřejnil nové datového rozhraní k seznamu SCAU
SÚKL
19. 12. 2024
Sekce:
Denní přehled
SÚKL informuje o veřejné konzultaci ke zdravotnickým prostředkům
Výzva k předložení důkazů pro hodnocení nařízení 2017/745 o zdravotnických prostředcích a nařízení 2017/746 a diagnostických zdravotnických prostředcích in vitro.
SÚKL
19. 12. 2024

