min
Sekce:
Zaměřeno na
Cesta léku
Objevením účinné látky začíná dlouhý proces ověřování vhodnosti a bezpečnosti léku před jeho uvedením na trh. Proces sledování u léků však nekončí ani úspěšnou registrací.
Pharmeca a.s.
17. 04. 2023
min
Sekce:
Denní přehled
Rozhodnutí SÚKL - 15. týden 2023
Přehled rozhodnutí SÚKL v oblasti cen a úhrad léků doručovaných veřejnou vyhláškou v týdnu od 11. 4. - 14. 4. 2023.
Pharmeca
15. 04. 2023
min
Sekce:
Denní přehled
Rozhodnutí SÚKL - 14. týden 2023
Přehled rozhodnutí SÚKL v oblasti cen a úhrad léků doručovaných veřejnou vyhláškou v týdnu od 3. 4. - 6. 4. 2023.
Pharmeca
11. 04. 2023
min
Sekce:
Denní přehled
Rozhodnutí SÚKL - 13. týden 2023
Přehled rozhodnutí SÚKL v oblasti cen a úhrad léků doručovaných veřejnou vyhláškou v týdnu od 27. 3. - 31. 3. 2023.
Pharmeca
03. 04. 2023
min
Sekce:
Vizualizace dat
Vliv rozhodnutí v odvolacích řízeních na rozhodovací praxi
Od 1. 4. 2023 nabízí na svých stránkách společnost Pharmeca a.s. nový pohled na rozhodnutí Ministerstva zdravotnictví ČR v odvolacích řízeních v oblasti cen a úhrad.
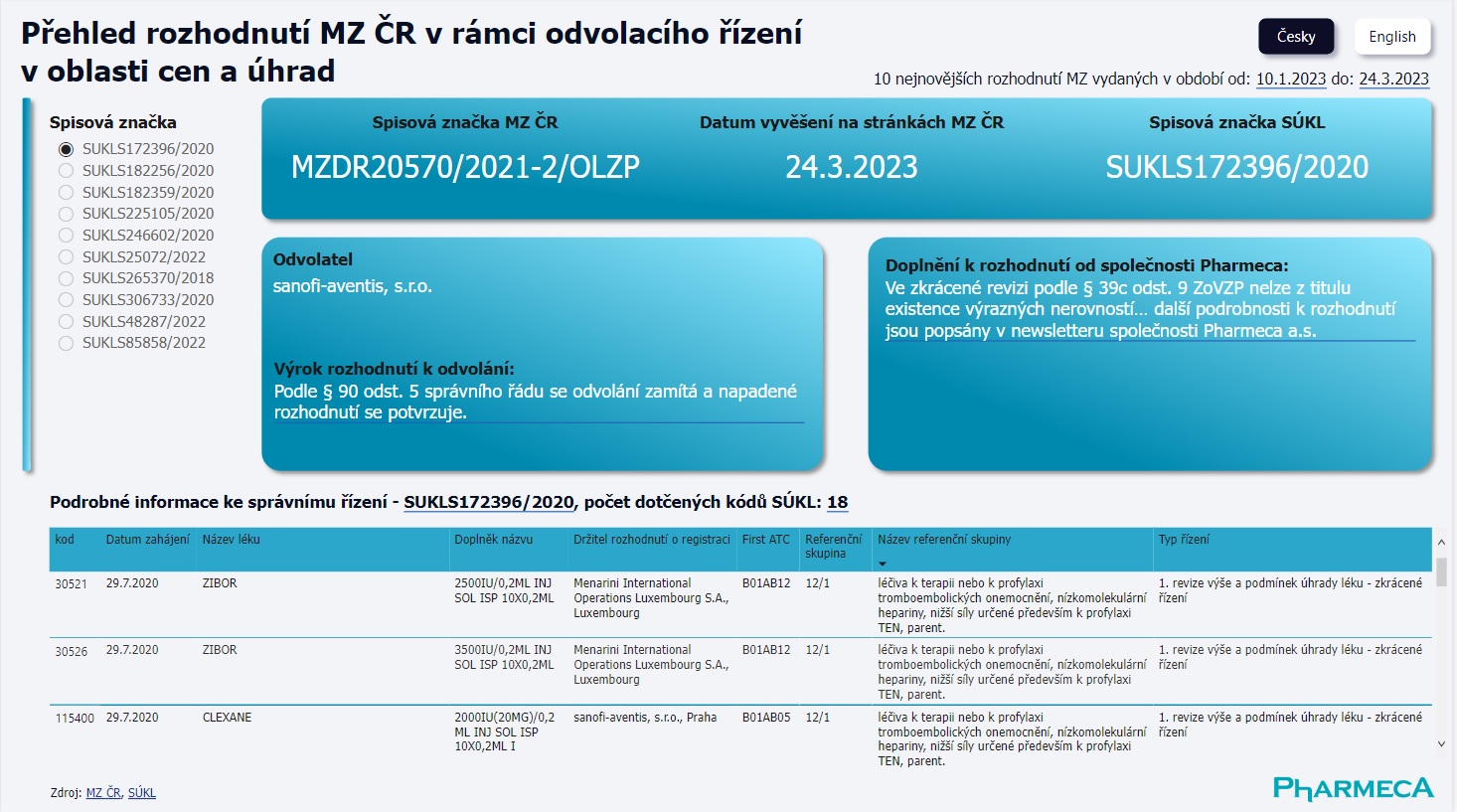

Pharmeca a.s.
01. 04. 2023
min
Sekce:
Denní přehled
Farmakoterapeutické informace 2023
SÚKL publikoval nové číslo bulletinu Farmakoterapeutické informace.
SÚKL
31. 03. 2023
min
Sekce:
Zaměřeno na
Novela zákona o léčivech v boji proti nedostupnosti léků v ČR
Dne 24. 3. 2023 bylo ukončeno připomínkové řízení k novele zákona o léčivech, která by měla pomoci řešit nedostupnost léků v ČR.
Pharmeca a.s.
29. 03. 2023
min
Sekce:
Denní přehled
Cesta pacienta k onkologické diagnostice a léčbě
Asociace inovativního farmaceutického průmyslu ve spolupráci se Zdravotnickým deníkem pořádají v úterý 28. března 2023 kulatý stůl na téma Cesta pacienta k onkologické diagnostice a léčbě.
AIFP, ZDN
27. 03. 2023